Главная задача компании «АстраЗенека» — улучшить результаты лечения пациентов, страдающих раком молочной железы, тем самым достигнув амбициозной цели — навсегда исключить рак из списка основных причин смертности. На протяжении всей истории нашей компании мы создавали лекарственные препараты, которые потенциально способны изменить практику лечения рака молочной железы. Несмотря на то, что мы уже продвинулись далеко вперед, нам еще многое предстоит сделать. Мы сохраняем приверженность поиску новых подходов к лечению рака молочной железы.
Рак молочной железы является самым распространенным типом рака у женщин в мире1 и основной причиной смертности от злокачественных новообразований среди женщин2. Мужчины также подвержены риску развития рака молочной железы, хотя и в гораздо меньшей степени, чем женщины3. Опухоль может развиться в различных структурах молочной железы, включая протоки, дольки или ткани между ними4.
За последние 50 лет методы лечения рака молочной железы изменились5. Мы гордимся тем, что благодаря многочисленным исследованиям в данной области вносим свой вклад в поиск более эффективных подходов к терапии.
Внедрение в клиническую практику мастэктомии (операции по удалению всей молочной железы6), химиотерапии, а также достижений в области скрининга и диагностики, а именно маммографии, и возросшая осведомленность о раке молочной железы, привели к повышению выживаемости пациентов с диагнозом рак молочной железы4,7.
Благодаря прогрессу в молекулярной биологии и генетике мы расширили представления о раке молочной железы на клеточном, молекулярном и геномном уровнях4. Сейчас мы знаем, что рак молочной железы принадлежит к числу наиболее биологически разнообразных типов злокачественных новообразований, и его развитие и прогрессирование стимулируют различные факторы.
Сегодня мы можем классифицировать формы заболевания и подбирать терапию на основании статуса гормональных рецепторов и рецепторов HER2 в опухоли, а также наличия или отсутствия у пациентов мутации в генах BRCA1/2. По мере того, как углубляется понимание различных факторов, приводящих к развитию рака молочной железы, появляются варианты лечения для новых подгрупп пациентов.
Как мы классифицируем рак молочной железы сегодня
Чтобы найти оптимальный подход к лечению рака молочной железы, крайне важно определить ключевые рецепторы или белки, которые могут управлять ростом опухоли. Экспрессия рецепторов или белков, в свою очередь, определяет классификацию рака молочной железы.

Классификация рака молочной железы: гормон-рецептор положительный рак молочной железы
Воздействие гормонов — фактор, управляющий развитием ткани молочной железы, поэтому неудивительно, что гормоны также играют важнейшую роль в развитии злокачественных новообразований. Их роль в образовании опухоли научно подтверждена уже более века назад8. Рост и пролиферация тканей молочной железы происходит в период полового созревания, когда гормональная стимуляция запускает клеточную дифференцировку. На изменения в период полового созревания большое влияние оказывают стероидные гормоны, эстроген9 и прогестерон, которые действуют как регуляторы развития и нормального функционирования молочных желез10.
Эти два стероидных гормона связываются с клеточными рецепторами и стимулируют рост. К сожалению, этот же механизм применяют опухолевые клетки, которые задействуют эстроген и прогестерон для стимуляции своего роста11.
Наличие рецепторов эстрогенов (РЭ) и/или рецепторов прогестерона (РП) на поверхности опухолевых клеток используется в одном из основных методов классификации рака молочной железы. Гормон-рецептор-положительной (ГР-положительной) считается опухоль молочной железы, более 1% клеток которой экспрессируют РЭ, РП или оба вида рецепторов12. Опухоль считается гормон-рецептор-отрицательной (ГР-отрицательной), когда менее 1% опухолевых клеток имеют эти рецепторы13.
Роль гормонов в развитии рака молочной железы была хорошо изучена. Первые лекарственные препараты, разработанные специально для лечения рака молочной железы, представляли собой гормональную терапию. Данные препараты препятствуют использованию опухолевыми клетками эстрогена или прогестерона и могут действовать различными способами.
У пациентов с диагнозом рак молочной железы рецепторы эстрогенов в опухоли встречаются гораздо чаще, чем рецепторы прогестерона, при этом около 80% всех случаев заболевания относятся к гормонозависимым и эстроген-рецептор-положительным (РЭ+) формам14. Случаи эстроген-рецептор-отрицательных/прогестерон-рецептор-положительных (РЭ-/РП+) опухолей чрезвычайно редки15 и поэтому лечение часто нацелено на сигнальные пути с участием эстрогенов.
Роль гормон-рецептор-положительного статуса в принятии решения о тактике лечения РМЖ
Ингибиторы ароматазы (ИА), например, предотвращают выработку эстрогена определенными тканями (кроме яичников), в то время как другие виды терапии, известные как селективные модуляторы рецепторов эстрогена, конкурируют с эстрогеном за связывание с рецептором, тем самым блокируя воздействие эстрогена16.
Другой вариант терапии, который прицельно воздействует на ГР+ рак молочной железы, заключается в применении селективных ингибиторов рецепторов эстрогена17, благодаря чему нарушается сигнальный путь РЭ и опухолевые клетки теряют способность использовать эстроген. Селективные ингибиторы рецепторов эстрогена часто применяются при метастатической стадии заболевания18 — когда рак распространился на другие части организма — и все чаще такие препараты используют в комбинации с другими препаратами для успешного преодоления резистентности к эндокринной терапии19,20.
В последние десятилетия количество лекарственных препаратов для лечения ГР+ рака молочной железы продолжает расти, но многое еще предстоит сделать. В настоящее время мы стремимся еще больше изменить жизнь женщин с таким заболеванием, опираясь на наш обширный опыт в разработке лекарственных препаратов.
Классификация рака молочной железы: HER2-положительный рак молочной железы
В начале 1980-х было обнаружено, что рецептор эпидермального фактора роста человека 2 (HER2), который помогает поддерживать нормальный жизненный цикл клеток, стимулирует чрезмерный рост и пролиферацию опухолевых клеток молочной железы при гиперэкспрессии рецепторов HER2 (избыточное количество рецепторов HER2 на поверхности клетки) или при амплификации гена HER2 (избыточное количество копий гена HER2 в ядре клетки)21.
Гиперэкспрессия рецепторов HER2 обнаруживается примерно в 20% случаев рака молочной железы и ассоциирована с агрессивным течением заболевания, высокой частотой рецидивов и повышенной смертностью22.
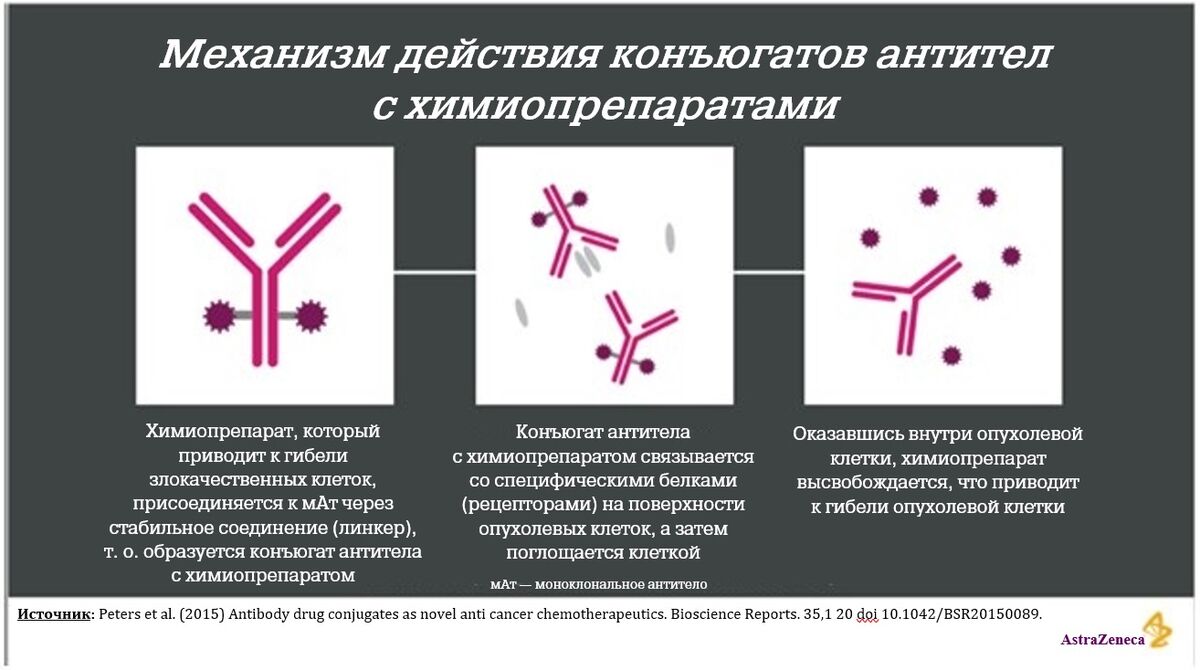
Роль положительного HER2-статуса в принятии решения о тактике лечения РМЖ
Хотя согласно сложившимся представлениям HER2-положительный (HER2+) рак молочной железы ассоциируется с неблагоприятным прогнозом23, ситуация значительно улучшилась, когда были разработаны моноклональные антитела к HER2, ингибиторы тирозинкиназы и конъюгаты антител с химиопрепаратами, таргетно воздействующие на данный онкогенный фактор24.
Конъюгат антитела с химиопрепаратом — это комплекс из двух противоопухолевых препаратов, сформированный по принципу «два в одном» и состоящий из цитотоксического препарата, также называемого химиопрепаратом, и моноклонального антитела (которое связывается со специфической мишенью, экспрессируемой на опухолевых клетках), которые соединены линкером. Это обеспечивает целенаправленную (таргетную) доставку цитотоксического препарата (обладающего, как известно, плохой специфичностью к опухолевым клеткам) непосредственно в опухолевую клетку, т. е. не затрагивая здоровые клетки25.
Классификация рака молочной железы: тройной негативный рак молочной железы (ТНРМЖ)
При тройном негативном раке молочной железы (ТНРМЖ) рецепторы эстрогена и рецепторы прогестерона не экспрессируются на поверхности опухолевых клеток, а также нет и гиперэкспрессии HER2, поэтому такой тип опухоли считается «негативным» по всем трем факторам. ТНРМЖ составляет 10–15 % всех случаев рака молочной железы и чаще встречается у женщин в возрасте до 40 лет. Эта специфическая форма рака молочной железы особенно агрессивна и характеризуется быстрым ростом, высоким риском метастазирования и, к сожалению, большей вероятностью рецидивов после лечения, по сравнению с другими типами рака молочной железы26,27.
Роль тройного негативного подтипа в принятии решения о тактике лечения РМЖ
Количество вариантов лечения, доступных для ТНРМЖ, значительно меньше, чем для других подтипов рака молочной железы, что связано с отсутствием известных терапевтических мишеней, определяемых на основании биомаркеров. Как и в большинстве случаев рака молочной железы, если опухоль еще не метастазировала, проводят хирургическое вмешательство, которое обычно сочетают с химиотерапией, позволяющей либо уменьшить опухоль для выполнения радикальной операции, либо снизить вероятность рецидива опухоли после операции. В некоторых случаях женщинам с ТНРМЖ может подойти иммунотерапия, когда для уничтожения опухоли активируется собственная иммунная система организма26.
Классификация рака молочной железы: РМЖ, ассоциированный с мутациями в генах BRCA1/2
Разработки в области генетики выявили дополнительные биомаркеры, которые могут применяться для таргетного воздействия на опухолевые клетки при раке молочной железы, а именно два гена предрасположенности к раку молочной железы — BRCA1 и BRCA228.
Гены BRCA1/2 считаются «опухолевыми супрессорами» и участвуют в восстановлении повреждений ДНК через процесс, известный как ответ на повреждение ДНК, в частности через репарацию путем гомологичной рекомбинации, которая представляет собой один из путей репарации. Стоит отметить, что в ответе на повреждение ДНК участвует фермент PARP (поли(АДФ-рибоза)-полимераза), который принимает участие в репарации однонитевых разрывов ДНК29,30.
Мутированные гены BRCA1/2 не могут выполнять свою функцию, и риск развития рака возрастает31. В среднем, женщина с мутациями в генах BRCA1 или BRCA2 может заболеть раком молочной железы к 80 годам с вероятностью до 70% (шанс – от 1 до 7 из 10)32.
Роль наличия мутаций в генах BRCA1/2 в принятии решения о тактике лечения РМЖ
На клеточном уровне мутации в генах BRCA1/2 приводят к нарушению репарации путем гомологичной рекомбинации. Чтобы выжить, клетка должна полагаться на другие пути репарации. Это можно использовать при таргетной терапии. Ингибиторы PARP блокируют работу фермента PARP и предотвращают восстановление однонитевых разрывов ДНК. Это приводит к увеличению числа двунитевых разрывов ДНК, репарация которых не может быть выполнена из-за нарушения механизма репарации путем гомологичной рекомбинации. Таким образом, клетка должна полагаться на резервный путь, который имеет низкую точность; в этот момент повреждение ДНК перестает быть управляемым процессом, что приводит к гибели опухолевых клеток33.
Как мы намерены менять подход к классификации и лечению рака молочной железы в будущем
Чтобы достичь нашей цели и исключить рак из числа основных причин смертности пациентов, необходимо изменить саму клиническую практику.
Вот уже более 40 лет компания «АстраЗенека» вносит значительный вклад в поиск новых методов лечения рака молочной железы, разрабатывая инновационные лекарственные препараты, включая таргетную терапию и другие варианты персонализированного лечения, которые играют роль в улучшении результатов терапии у женщин, страдающих раком молочной железы.
Рак молочной железы является одним из приоритетных направлений работы компании «АстраЗенека». Мы являемся лидерами в научных разработках и определяем новые пути совершенствования терапии для тех групп пациентов, у которых заболевание ассоциировано с неблагоприятным прогнозом.
С целью внести вклад в преодоление текущих нерешенных медицинских проблем, мы исследуем биологическое разнообразие опухолей молочной железы на различных стадиях заболевания при различных линиях терапии. Опираясь на наше постоянно растущее понимание биологических процессов, лежащих в основе рака молочной железы, мы стремимся трансформировать пути лечения и помочь изменить жизнь тех, кто живет с этим заболеванием.

