Рак поджелудочной железы занимает седьмое место в структуре смертности от онкологических заболеваний в мире. Такая высокая распространенность обусловлена сложностью биологической природы и лечения заболевания1,2. Помимо этого, оно имеет один из худших показателей выживаемости пациентов среди всех часто встречающихся видов рака. Только 9% пациентов с распространенной (метастатической) формой заболевания живут более пяти лет после постановки диагноза2,3. Протоковая аденокарцинома поджелудочной железы (ПАПЖ) — самая частая форма рака поджелудочной железы (на ее долю приходится 95% случаев4) по сравнению с нейроэндокринными (НЭО), или островковоклеточными опухолями, которые встречаются гораздо реже4.
ПАПЖ считается одной из самых агрессивных форм рака5. В силу многообразия генетических мутаций и плотности соединительной ткани, образующей поджелудочную железу, ПАПЖ относится также к одному из наиболее химиорезистентных видов рака1,6. ПАПЖ имеет крайне неблагоприятный прогноз, о чем свидетельствует однолетняя выживаемость около 20% пациентов на всех стадиях заболевания7. На сегодняшний день причины рака поджелудочной железы изучены недостаточно хорошо, хотя были выявлены определенные факторы риска, такие как: курение, диабет, ожирение и хронический панкреатит2. Благодаря ведущимся исследованиям и разработкам мы имеем основания с оптимизмом смотреть на будущее терапии этого зачастую смертельного вида рака.
Чтобы понять, какую сложную и комплексную проблему представляет собой рак поджелудочной железы, необходимо рассмотреть ту важную роль, которую поджелудочная железа играет в регуляции функций организма.
Поджелудочная железа: приведение организма в равновесие
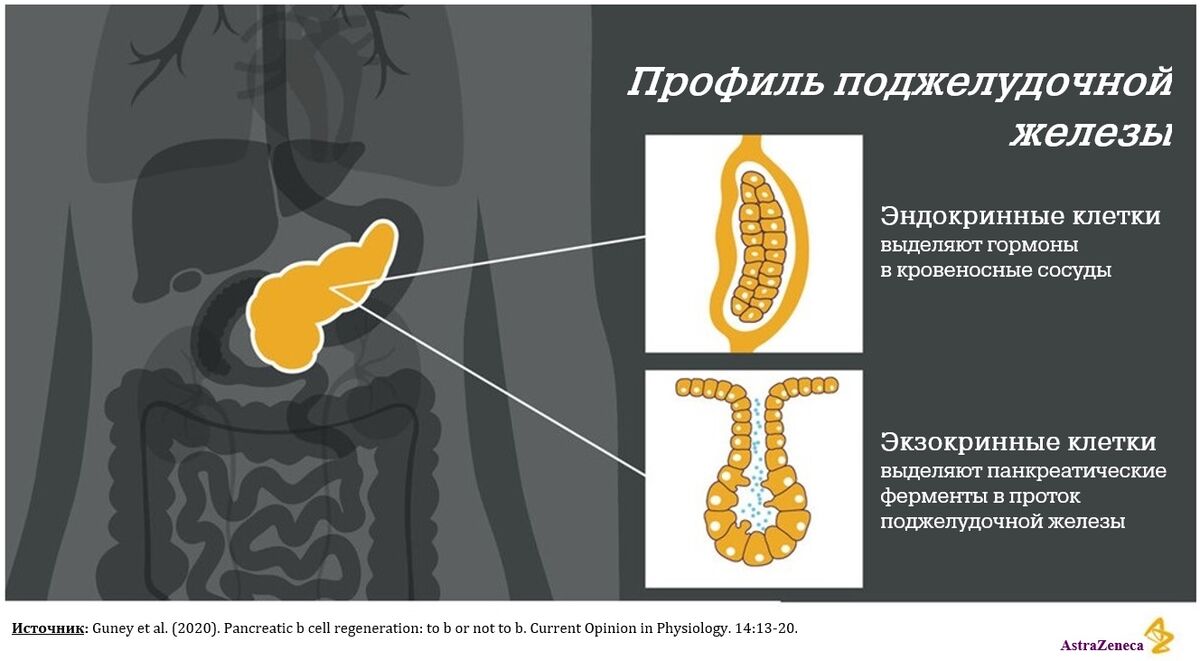
Поджелудочная железа — это железистый орган, расположенный в брюшной полости рядом с печенью. Поджелудочная железа играет двойную роль в регуляции функций организма8.
- В эндокринной системе выделяет гормоны, в том числе регулирующие уровень сахара в крови — инсулин и глюкагон.
- В экзокринной системе выделяет ферменты в пищеварительный тракт через проток в двенадцатиперстную кишку.
Опухоли поджелудочной железы
Рак поджелудочной железы представлен двумя основными группами опухолей в соответствии с двумя системами организма, в которых поджелудочная железа играет ключевую роль: опухоли, которые формируются в экзокринных клетках, и опухоли, которые формируются в эндокринных клетках.
Нейроэндокринные опухоли поджелудочной железы (НЭО), или островоклеточные опухоли — редкий тип рака, который образуется в эндокринных клетках9. На НЭО приходится менее 2% всех случаев рака поджелудочной железы, и прогноз по ним благоприятнее, чем по более распространенным типам рака7.
На экзокринные опухоли приходится 95% случаев рака поджелудочной железы, и самый часто встречающийся тип экзокринной опухоли — это ПАПЖ4. ПАПЖ развивается из клеток, которые выстилают протоки в поджелудочной железе. Эти протоки переносят пищеварительные соки, содержащие ферменты, в главный проток поджелудочной железы, а затем в первый отдел тонкой кишки4.
Поскольку это заболевание имеет тенденцию быстро распространяться и симптомы часто не проявляются до более поздних стадий, более чем у 80% пациентов с раком поджелудочной железы диагноз ставится, когда болезнь уже распространилась на другие органы. Для таких пациентов средняя выживаемость составляет менее одного года10,11.
Быстрое развитие этого заболевания обусловлено многими факторами, в том числе близостью крупных кровеносных сосудов, расположенных в поджелудочной железе, которые могут быть легко «захвачены» раковыми клетками, а также неспецифической симптоматикой12. Поскольку симптомы часто незаметны, постановка диагноза чрезвычайно сложна, что значительно снижает шансы на выживание и превращает этот рак в «тихого убийцу».

Медленное развитие
Раньше пациенты с распространенным раком поджелудочной железы сталкивались с неблагоприятным прогнозом из-за агрессивного характера заболевания и ограниченных возможностей терапии относительно других часто встречающихся видов рака, особенно в вопросе таргетной терапии13.
В настоящее время стандарт лечения рака поджелудочной железы подразумевает хирургическое вмешательство, которое показано примерно 20% пациентов с распространенной формой заболевания14. Другие опции включают химиотерапию и лучевую терапию, что свидетельствует о потребности в более эффективных вариантах лечения15. Тяжесть симптомов при распространенном раке поджелудочной железы влечет дополнительные проблемы, поскольку симптомы могут влиять на эффективность лечения и качество жизни пациента16.
Рак поджелудочной железы: возможно ли управлять этим сложным заболеванием через биомаркеры?
В настоящее время получено множество данных о том, что означает статус по биомаркеру для таких видов рака, как рак молочной железы, простаты, яичников, легких, желудка. С появлением технологий геномного профилирования и селективной молекулярной таргетной терапии биомаркеры стали играть более важную роль и в клиническом ведении пациентов с раком поджелудочной железы.
При ПАПЖ некоторые гены-супрессоры опухолей (которые активно предотвращают образование рака) мутируют, что приводит к агрессивному росту опухоли17. Эти гены, включая BRCA1/2, PRSS1 и CDKN2A — лишь некоторые из прогностических биомаркеров метастатического рака поджелудочной железы и могут применяться не только для простой диагностики: они улучшают потенциальные результаты лечения и помогают идентифицировать семейный риск18,19.
Таргетная противораковая терапия — это препараты, которые воздействуют на определенные молекулы, участвующие в росте и выживании раковых клеток. Чтобы понять, как работает таргетная терапия, важно понять механизмы, действующие в раковых клетках.
Гены BRCA1/2 формируют часть каскадного ответа на повреждение ДНК (ОПД), который включает в себя различные сигнальные пути, по которым идет восстановление повреждения ДНК. Когда гены BRCA мутируют, этот процесс восстановления тормозится, и риск развития рака увеличивается20. Примерно у 5–7% пациентов с раком поджелудочной железы прогнозируется наличие герминогенной мутации BRCA, которая может выступать в качестве определяющего признака при доступе к соответствующим вариантам лечения21.
Раковые клетки характеризуются высоким уровнем повреждения ДНК, потерей одного или нескольких путей репарации ДНК и повышенной способностью репликации ДНК. Эти свойства могут привести к специфическим для рака зависимостям ОПД, которые можно использовать в качестве потенциальных целей терапии. За счет воздействия на эти зависимости таргетные препараты могут заставлять раковые клетки атаковать самих себя, что приведет к их гибели22.
Будущее исследований и разработок в области рака поджелудочной железы
Распространенность рака поджелудочной железы будет расти, если мы не инициируем дальнейшие исследования и не добьемся прорыва в диагностике и лечении. Современные разработки сосредоточены на раннем выявлении с помощью скрининга и тестирования на биомаркеры, в сочетании с более эффективной таргетной терапией.
BRCA-мутированный метастатический рак поджелудочной железы — это разрушительное заболевание, где существуют огромные неудовлетворенные потребности в эффективной терапии, однако благодаря существующим и находящимся в разработке инновационным решениям в генетическом тестировании и применении биомаркеров, изучению потенциала таргетной терапии и непрерывным исследованиям мы движемся вперед, помогая изменить прогноз для пациентов. Мы уверены, что для увеличения показателей выживаемости при раке поджелудочной железы необходимо повышать осведомленность и стимулировать изменения к лучшему там, где они возможны.

